Kui kõik sujub oodatult, võib lähiaastatel muutuda Regionaalhaigla leukeemia- ja lümfoomipatsientidele kättesaadavaks uue põlvkonna ravimeetod, milles kasutatakse patsiendi enese rakke.
Tekst: Anu Jõesaar
Illustratsioonid: Tanel Mahlakõiv
Põhja-Eesti Regionaalhaigla, Tartu Ülikooli Kliinikum ja biotehnoloogiafirma Icosagen on ühendanud jõud, et välja arendada ja tuua Eesti patsientideni uudne personaalne rakuteraapia. Esialgu annab see uue lootuse verevähipatsientidele, kuid võib tulevikus olla kasutatav ka teiste vähiliikide ja raskete haiguste raviks.
Natuke ulmefilmi moodi
Tänapäeval on vähiravis kasutusel kolm ravimeetodit: kirurgiline ravi, kiiritusravi ja süsteemravi (keemiaravi, bioloogiline ravi, hormoonravi, immuunravi). Enamasti kasutatakse vähkkasvajate ravis mitme raviviisi kombinatsioone. Kõige sobivama ja tõhusama ravimeetodi valiku otsustab arst koostöös patsiendiga ja alati lähtutakse kindlast reeglist: haiguse ravimisel ei tohi kahjustada tervist ega raskendada tervislikku seisundit.
Teatud vähivormide korral aga n-ö klassikalistest ravimeetoditest ei piisa. Seetõttu on uued vähiravimid, millel on parem efektiivsus ja madalamad kõrvaltoimed, kogu maailmas väga oodatud.
Eestisse ongi nüüd jõudmas raku- ja geeniteraapia ehk uudne terapeutiliste ravimite kategooria, mida Euroopa Ravimiamet klassifitseerib lühendi alla ATMP (advanced therapeutic medicinal product). Eesti seadusandluses kasutatakse väljendit „uudne ravim“.
Meetodi olemust aitab lahti seletada PhD Tanel Mahlakõiv biotehnoloogiaettevõttest Icosagen.
„Need ravimid muudab uudseks eelkõige nende määratlus või kuju. Need ei ole tabletid ega süstitavad vedelikud, nagu oleme harjunud. Uudseks ravimiks võib olla elus inimese rakk või näiteks viiruselaadne osake, mis viib inimese kehasse korrektse järjestusega DNA. See kõlab natuke ulmefilmi moodi, kuid on tänapäeval juba tegelikkus. Ehkki esialgu on ATMP kategoorias heaks kiidetud ravimeid mõnikümmend, on neid kliiniliste katsetuste järgus palju rohkem, isegi sadu.“
Rakk „õpetatakse“ kehas vähirakke hävitama
Immuunrakke on vähivastases rakuteraapias katsetatud juba aastakümneid, kuid esimene efektiivne rakuravi kiideti heaks 2017. aastal. Selleks on rakuteraapia CAR-T, mis tuleb sõnadest chimeric antigen receptor – kimäärne antigeeni retseptor. Just seda teraapiat ongi kavas Eestis kasutama hakata.
CAR-T ravi seisneb Mahlakõivu selgitusel inimese immuunraku (T-raku) geneetilises muundamises, et anda sellele võime ära tunda konkreetset vähitüüpi. „Rakud isoleeritakse patsiendi verest, nendesse viiakse viirusvektoriga uus geen, mis kodeerib kimäärset antigeeni retseptorit (CARi), ja täiustatud rakud manustatakse patsiendile tagasi. CAR aitab T-rakul ära tunda konkreetset molekuli vähiraku pinnal, käivitades tuumorraku hävitamise.“
Konkreetselt praegu ettevalmistatav rakuravi nimega CD19 CAR-T annab T-rakkudele võime hävitada kehas kõik B-rakud, mida nad eristavad CD19 valgu järgi raku pinnal.
„Tervel inimesel on B-rakud immuunsüsteemi väga oluline komponent, nad toodavad nakkuse korral antikehi. Kuid suurel osal leukeemia- ja lümfoomipatsientidel on just B-rakud muteerunud ning omandanud võime lõputult paljuneda – piltlikult öeldes on immuunrakud ise muutunud vähiks. Nende kõrvaldamisel võiks lahti saada ka haigusest,“ kirjeldab Mahlakõiv.
Keda saab uus ravi aidata?
Regionaalhaigla hematoloog Annett Vapper ütleb, et CAR-T on muutnud pahaloomuliste verehaiguste käsitlust kogu maailmas. „Mitmetele patsiendigruppidele, kellel muud raviviisid on ammendunud või osutunud ebaefektiivseks, annab uus ravimeetod võimaluse täielikult terveneda või saada juurde tervena elatud aastaid.“
Ta lisab, et tulevikus võib CAR-T tehnoloogia pakkuda ravivõimalusi näiteks ka mõnede onkoloogiliste ja reumatoloogiliste haiguste puhul. Autoimmuunhaigustest on saadud edukaid tulemusi näiteks süsteemse erütematoosse luupuse, müasteenia ja süsteemse skleroosi ravis.
Niisiis on rakuteraapias palju potentsiaali ainuüksi CAR-T suuna arendamisel ning Mahlakõiv mainib, et sarnased uuringud käivad ka loomulike tapjarakkude (natural killer cell) teraapia ja erinevate tüvirakuteraapiate rakendamiseks. Teadlaste silmis on need reaalsed sammud personaalse meditsiini toomisel inimeseni – inimese enda rakkudest valmistatakse temale sobiv ravim.
Teerajajaks Eesti tervishoius
Põhja-Eesti Regionaalhaigla ja TÜ Kliinikum on löönud käed biotehnoloogiafirmaga Icosagen, et CD19 CAR-T rakuravi patsientideni viia. See on keeruline protsess ning vajab kõrgetele kriteeriumitele vastavaid tingimusi, kvaliteedikontrolli protseduure, haiglate ja personali ettevalmistamist.
Icosagen pakub siin teaduslikku kompetentsi, arendus- ja tootmisüksuste ülesseadmist. Regionaalhaigla ja TÜ kliinikumi kanda jääb meditsiiniline pool ehk kõik, mis seotud patsiendiga: immuunrakkude hankimine, patsiendi ettevalmistamine, rakuteraapia manustamine, patsiendi monitoorimine jne.
Regionaalhaigla kestliku arengu teenistuse juhataja Priit Tohver ütleb, et alustatud koostöö võimaldab Regionaalhaiglal ellu viia oma visiooni – olla teerajaja Eesti tervishoius.
„Teerajajad ei pea olema üksi: sageli jõuab koos kaugemale. Nõnda ka CAR-T rakuravi arendamisel. Usume, et koostöös Icosageni ja Tartu Ülikooli Kliinikumiga suudame elupäästva ravi tuua meie patsientideni palju kiiremini kui üksinda pusides. Alustame hematoloogiast, kuid loome eeldused selle ravimeetodi juurutamiseks ka teistel meie võtmeerialadel, nagu onkoloogia, kardioloogia, reumatoloogia jne,“ ütleb ta. „Igal juhul on rakuteraapia tervishoius praegu võtmetrend, millest Eesti ei tohi maha jääda, kui soovime oma patsientidele pakkuda parimat võimalikku ravi. Regionaalhaiglas soovime olla selle kriitiliselt olulise ja elumuutva arengu eesotsas.“
Dr Tohver rõhutab, et rakuravi arendamine toob Regionaalhaiglale ka palju väljakutseid. Uudse ravimi tootmine on ulatuslikult reguleeritud ning nõuetele vastamine eeldab järjepidevat tööd. „See ei ole „üks kord ja tehtud“ – kõrgeid standardeid peab hoidma aastast aastasse,“ hindab ta.
Ta toob näite, et uudse ravimeetodi juurutamine eeldab uusi raviteekondi.
„Raviteekond ei ole ainult patsiendile ravi manustamise süsteem,“ ütleb ta. „Me peame tagama ka tema ravieelse ettevalmistuse ja hilisema jälgimise. Samuti peame olema valmis kiireks tegutsemiseks võimalike kõrvaltoimete korral, kuhu võib olla vaja kaasata meie kõrgeima etapi intensiivravivõimekust. Peame suutma patsienti jälgida ja nõustada siis, kui ta koju läheb. Kõiki neid tegevusi tuleb meil koordineerida nii oma haiglas kui ka kogu tervishoiusüsteemis, et patsiendi raviteekond oleks ohutu ja võimalikult tõhus.“
Kokkuvõttes on selle protsessi juures kõigil palju õppida.
„Nii mitme osapoolega projektis on oluline projektijuhtimise oskus, ressursside ja vajaduste kokkuviimine jne. Teeme endast parima, et patsiendid jõuaksid ravini võimalikult kiiresti, aga turvaliselt,“ võtab eesootava kokku Icosageni teadlane Tanel Mahlakõiv.
Teadlaste hinnangul on esimese patsiendini võimalik jõuda 18–24 kuu pärast. Kuna teraapia on uudne ja selliseid Eestis pole arendatud ega ka manustatud, tuleb taotleda Ravimiametilt luba ja see on keeruline protsess. Peamine on patsiendi ohutus ja just seda Ravimiamet ka hindab.
Ühisprojekti peamine eesmärk on muuta tänapäevane ravi Eesti patsiendile kättesaadavaks. Rakuravi on kallis – hetkel maksavad heakskiidetud personaalsete ravimite doosid 300 000–400 000 eurot, ideaalis lähebki vaja ainult üht doosi. Tanel Mahlakõivu hinnangul on Eestis võimalik seda hinda mitu korda allapoole tuua ja uudset ravimeetodit meie Tervisekassale taskukohasemaks muuta.
Ida-Euroopa peab pingutama, et järele jõuda
Kuigi Eestis räägime rakuravist kui väga uudsest meetodist, võib Tanel Mahlakõiv, kes viimased viis aastat on töötanud USA-s, kinnitada, et see valdkond areneb väga kiiresti, maha jääma kipub kahjuks just Ida-Euroopa.
„Nagu ikka, on uudsete tehnoloogiate ja nii ka ravimite arendamises esirinnas USA, seal on ressursid ja mentaliteet, mis seda võimaldab. Kuigi rahvaarvult on USA väiksem kui Euroopa, tehakse seal rakuteraapia valdkonnas kümme korda rohkem kliinilisi katseid. Nemad koorivad ka koore, st toovad ravimid turule ja saavad kasumi. Kahjuks on Euroopa ravimiarenduste ja katsetuste poolest killustunud, hoolimata Euroopa Liidu püüdlustest regulatsioone ühtlustada. COVID pakkus hea näite selle kohta, kui mahajäänud me oleme, kui tekib probleem,“ tuletab teadlane meelde, et just USA arendas maailmale SARS-CoV-2 vaktsiinid.
Rakuravi kohta ütleb Mahlakõiv, et Põhjamaad ostavad oma patsientidele kallid CD19 CAR-T ja BCMA CAR-T ravimid sisse. Leedu on aga selles konkreetses asjas Ida-Euroopa suur erand, seal on jõutud nii kaugele, et on loodud CAR-T tootmiseks labor ja tingimused ning juba ligi kaks aastat patsiente ravitud.
Teadlase sõnul liigub rakuteraapia, ka CAR-T rakuteraapia, „off-the-shelf“ allogeense rakuteraapia suunas, mis tähendab seda, et ravi valmistatakse ühe inimese rakkudest, aga manustada saab seda paljudele. Sel juhul poleks ravi enam personaalne – see oleks odavam ja kiiresti kättesaadav. „Isiklikult töötasin USA-s ettevõttes, kus arendati rakuravimeid platsentast ja nabaväädiverest pärinevatest immuun- ja tüvirakkudest. Sellised ravimid on rakuteraapia n-ö püha graal. Aga need eeldavad tehnoloogilist hüpet ja hetkel oleksid ka liialt kallid,“ ütleb Mahlakõiv.
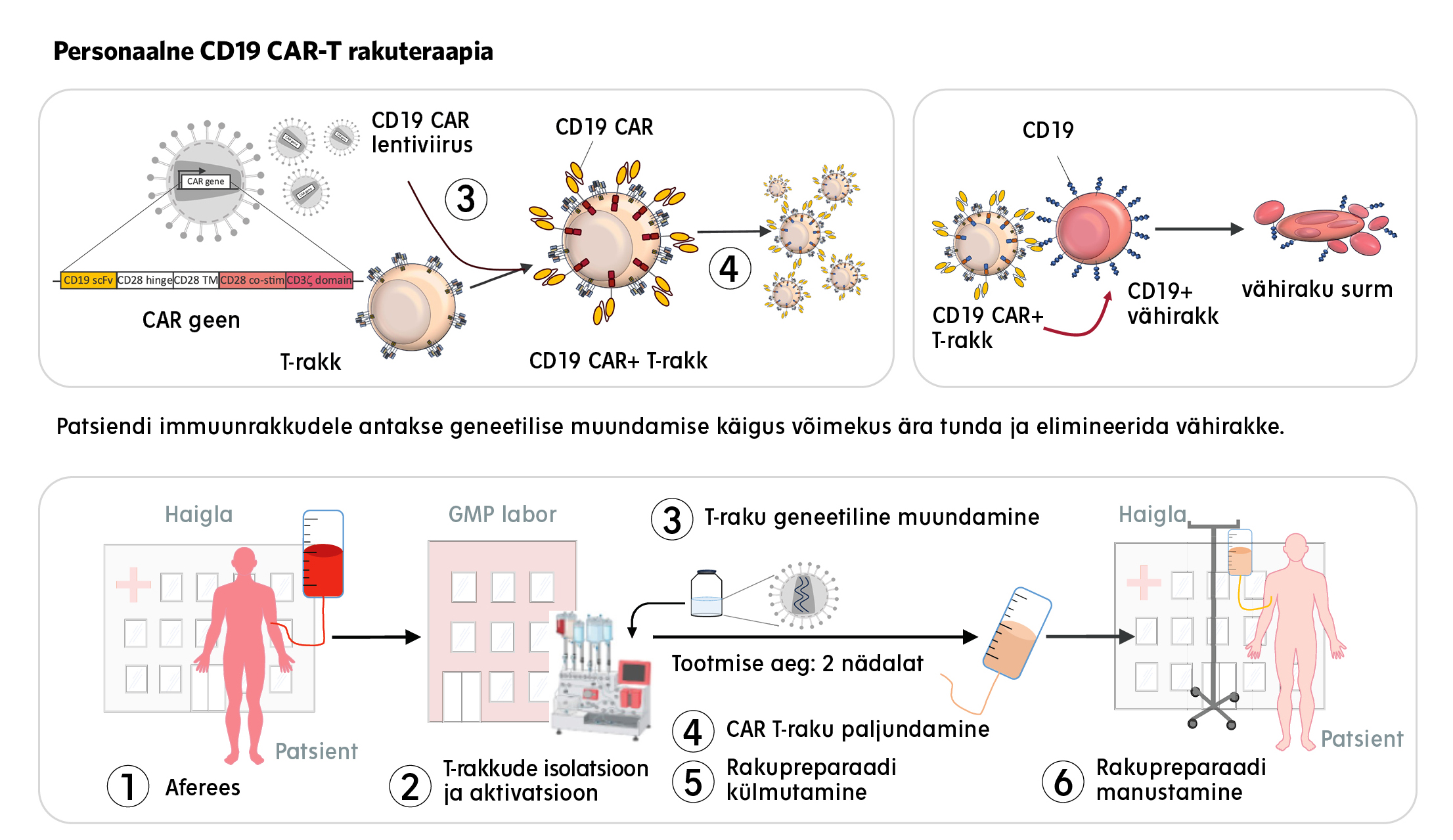
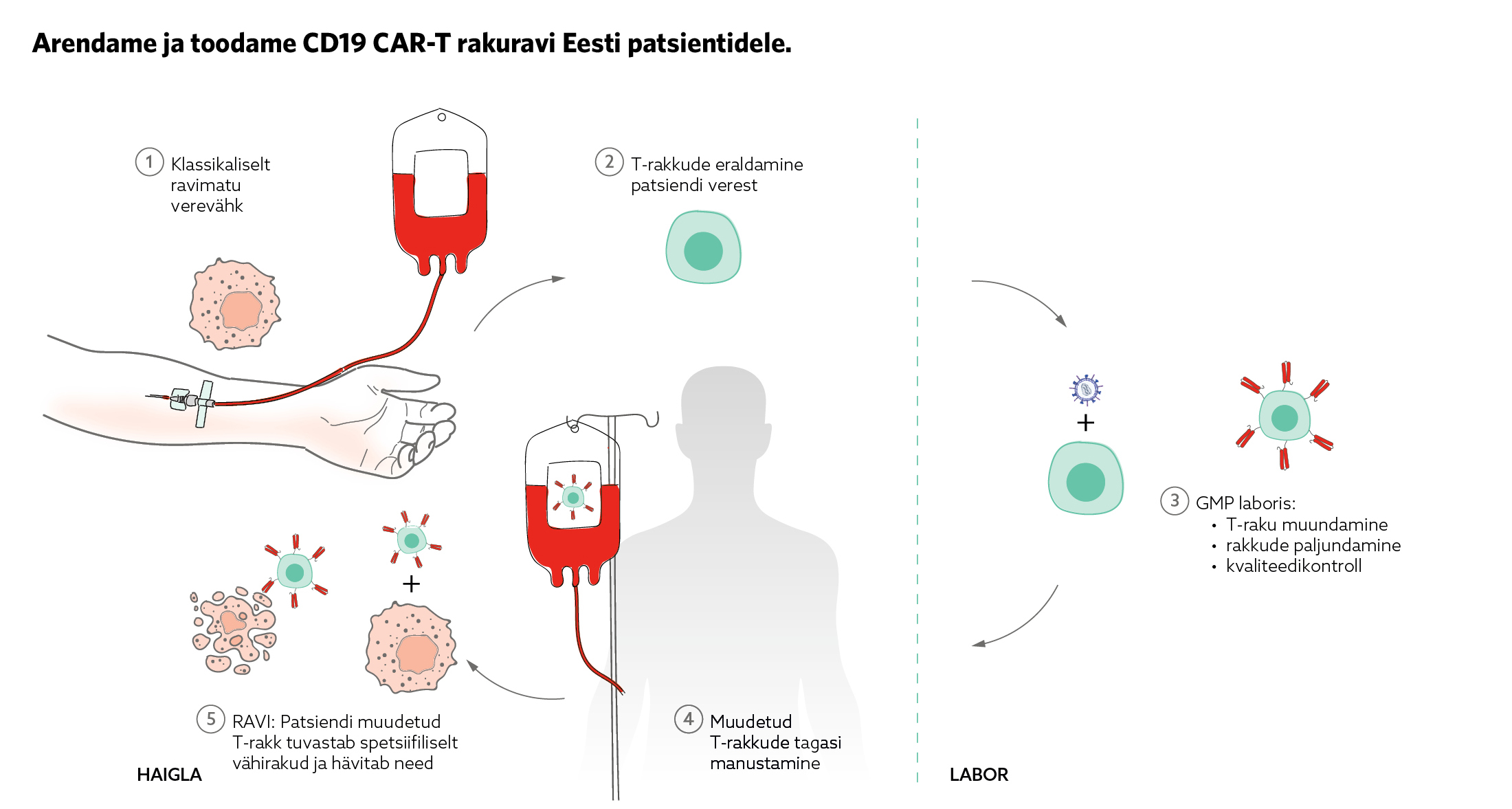
Kuidas rakuravi käib
- Patsiendi jaoks algab CAR-T teekond T-lümfotsüütide kogumisega. Kui on selgunud ravivajadus ja sobivus selleks, kogutakse tema perifeersest verest afereesi meetodil mononukleaarid, millest eraldatakse T-rakud. Eelduseks on, et patsiendil oleks vajalikke rakke ringlevas veres piisaval hulgal ja need oleksid hea funktsiooniga, mida võib mõjutada ka varasem ravi.
- Haiglas eraldatakse patsiendi verest immuunrakud ja saadetakse tootmislaborisse.
- Laboris muundatakse ja paljundatakse rakke, see võtab aega umbes kaks nädalat.
- Enne rakkude taasmanustamist saab patsient lümfodepletsiooni ehk madala tasemega keemiaravi, et valmistada keha ette CAR-T rakkude manustamiseks. Valminud CAR-T rakud kantakse patsiendile tagasi kas värskel kujul või külmsäilitatuna. Taasmanustamise protseduur ise on lihtne, rakud viiakse otse veeni.
- Järgneva kuu jooksul jälgitakse patsienti haiglas hoolikalt varaste kõrvaltoimete suhtes, millest olulisemad on tsütokiinide vabanemise sündroom, infektsioon ja immuunefektorrakkudega seostatav neurotoksilisuse sündroom. Tegemist on seisunditega, mis juba esimeste sümptomite tekkel nõuavad vältimatut sekkumist ja ladusat raviteekonda. Seetõttu on protsessi vältimatuks osaks interdistsiplinaarne koostöö ja standardkäsitluse kokkulepped.
- Kui rakuravi vahetu periood on läbitud, jääb patsient ambulatoorsele jälgimisele, mille käigus tuleb muu hulgas hinnata ka CARi püsimist perifeerses veres.
